GT3:
Diabetes Mellitus
Autor: João Maximiano
Faculdade de ciências médicas UNIFENAS-BH
Diabetes melito (conceito): refere-se
a um grupo de distúrbios metabólicos comuns que compartilham o fenótipo da
hiperglicemia. Existem vários tipos distintos de DM que são causados por uma
interação complexa de fatores genéticos e ambientais.
Classificação: inclui
quatro classes principais:
·
Diabetes tipo 1 – relativo à destruição das
células β do pâncreas levando à deficiência absoluta de insulina.
·
Diabetes tipo 2 – relativo à um defeito
progressivo na secreção de insulina juntamente à um aumento na resistência a
este hormônio.
·
Outros tipos específicos de diabetes como
causa de uma disfunção genética das células β, defeito genético na ação da
insulina, doenças do pâncreas exócrino como a fibrose cística, ou sob efeito de
drogas ou agentes químicos (tratamento da AIDS ou após transplante de órgãos).
·
Diabetes melito gestacional – desenvolvida
durante à gravidez tem como base resistência à insulina.
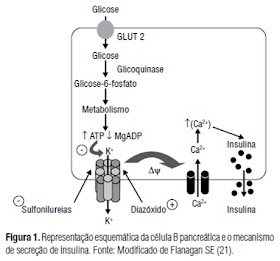
Secreção de insulina
A
glicose é o principal estimulante na secreção de insulina bastando valores
sanguíneos superiores à 70mg/dL para ocorrer a estimulação. A estimulação
ocorrerá nos seguintes passos:
1) A
glicose (>70mg/dL) se ligará a receptores GLUT2 presentes nas células
β-pancreáticas sendo endocitada para o interior da célula.
2) A
glicose será fosforilada pela enzima glicoquinase em glicose-6-fosfato
impedindo seu retorno ao interstício.
3) A
glicose-6-fosfato recém formada será metabolizada produzindo ATP.
4) O
ATP levará ao fechamento dos canais K+ ocasionando a despolarização
da membrana celular.
5) A
despolarização da membrana celular ocasionará a abertura dos canais Ca2+
voltagem-dependentes levando ao influxo de Ca2+.
6) O Ca2+
levará a infusão dos grânulos de insulina na membrana celular causando sua
exocitose (secreção).
Obs. Existem peptídeos
denominados incretinas, liberados pelas células neuroendócrinas do trato
gastrointestinal no momento da alimentação, que amplificam a liberação de
insulina.
Ação
da insulina
A
insulina se liga ao seu receptor na célula alvo levando à auto-fosforilação
deste receptor que, por sua vez, recruta moléculas sinalizadoras intracelulares
tais como os substratos do receptor de insulina (IRS). Tais substratos iniciam
uma complexa cascata de fosforilações que culminará no acoplamento de receptores
GLUT na membrana celular permitindo a entrada de glicose. Outros efeitos
notáveis da insulina mediados por segundos mensageiros constituem na indução da
glicogênese, síntese de proteínas, lipogênese etc.
Diabetes melito tipo 1
Resulta
da interação de fatores genéticos, ambientais e imunológicos que acabam
acarretando a destruição das células β, assim como uma deficiência de insulina.
Esta destruição de células β ocorre por um processo auto-imune derivado de uma
predisposição genética e desencadeado por uma ocasião na qual a demanda de
insulina se torna maior, por exemplo: na puberdade ou em infecções.
Fisiopatologia
No
processo de destruição auto-imune, excetuando as células β, não ocorrerá destruição das outras células do
pâncreas endócrino. Do ponto de vista patológico, as ilhotas pancreáticas são
infiltradas com linfócitos (em um processo denominado insulite). Após a destruição das células β, o processo inflamatório
se enfraquece, as ilhotas tornam-se atróficas e a maioria dos marcadores
imunológicos desaparece. As anormalidades incluem:
·
Auto-anticorpos para a célula insular
·
Linfócitos ativados nas ilhotas, nos
linfonodos peripancreáticos e na circulação sistêmica.
·
Linfócitos T que proliferam quando
estimulados por proteínas das ilhotas
·
Liberação de citocinas dentro da insulite.
As
células β-pancreáticas parecem ser mais susceptíveis à destruição na presença
das seguintes citocinas: 1) TGF-α, 2) interferón γ e 3) IL-1.
A
destruição é mediada por Linfócitos T e não pelos auto-anticorpos insulares,
uma vez que, esses anticorpos não reagem com a superfície das células
pancreáticas.
As
moléculas das ilhotas que funcionam como alvo para o processo auto-imune
incluem:
·
Insulina
·
Ácido glutâmico
·
Descarboxilase
·
Fogrina
·
As
células β de um indivíduo normal não diferem das células de um indivíduo com DM
pois quando transplantadas sofrem destruição equivalente.
Marcadores imunológicos: os
auto-anticorpos para as células das ilhotas (ICA) são uma combinação de
diferentes anticorpos dirigidos para as moléculas das ilhotas pancreáticas,
tais como GAD, insulina e IA-2/ICA-512, e funcionam como um marcador do
processo auto-imune do DM tipo 1.
Diabetes tipo 2
A
resistência à insulina e sua secreção de maneira anormal são fundamentais para
o surgimento do diabetes tipo 2. Presume-se que um aumento na resistência à
insulina precede a alteração na secreção deste hormônio, mas apenas quando esta
secreção se torna anômala é que se instala o diabetes.
Fisiopatologia
O DM
tipo 2 caracteriza-se por:
·
Menor secreção de insulina
·
Produção hepática excessiva de glicose
·
Metabolismo anormal de gorduras
Ø Inicio do distúrbio: a
tolerância à glicose continua sendo quase normal, não obstante a resistência à
insulina, pois as células β-pancreáticas realizam uma compensação aumentando a
produção de insulina.
Ø Fase intermediária: com
a progressão da hiperinsulinemia compensatória, as ilhotas pancreáticas
tornam-se incapazes de preservar o estado hiperinsulinêmico instalando-se uma
tolerância à glicose diminuída (TGD), caracterizada por elevações da glicose
pós-prandial.
Ø Fase final: um declínio
adicional na secreção de insulina e um aumento na produção hepática de glicose
resultam em diabetes manifesto com hiperglicemia de jejum. Finalmente pode
ocorrer falência das células β-pancreáticas.
Anormalidades metabólicas no DM tipo 2:
A
resistência à insulina constitui uma característica proeminente do DM tipo 2 e
resulta de uma combinação de susceptibilidade genética e obesidade. A
resistência a insulina prejudica a utilização da glicose pelos tecidos
sensíveis à insulina e aumenta a produção hepática de glicose. O maior débito
hepático de glicose é responsável pelos maiores níveis de glicose plasmática em
jejum (GJP), enquanto que a menor utilização periférica de glicose resulta em
hiperglicemia pós-prandial.
O
mecanismo molecular que resulta em resistência à insulina no DM tipo 2 incluí:
·
Reduzidos números de receptor e da
tiroquinase (causa menos influente).
·
Defeitos pós-receptor, ou seja, na
fosforilação/desfosforilação regulados pela insulina (defeito mais influente)
ex: uma PI-3-quinase sinalizadora com defeito pode reduzir a translocação de
GLUT4 para a membrana plasmática.
Outros
anormalidades incluem acumulo de lipídeos no interior dos miocitos devido à
baixa oxidação dos ácidos graxos, podendo gerar espécimes reativas de oxigênio,
tais como peróxidos lipídicos.
Convém
ressaltar que nem todas as vias de transdução dos sinais para a insulina são
resistentes aos efeitos da insulina (ex: aqueles que controlam o crescimento e
diferenciação celular). Consequentemente a hiperinsulinemia compensatória pode
exarcebar a ação da insulina por meio dessas vias, acelerando potencialmente as
condições relacionadas com o diabetes, tais como aterosclerose.
A
obesidade que acompanha a insulina principalmente a relacionada à um índice
cintura quadril (ICQ) elevado, sustenta as seguintes diretrizes:
·
As células adiposas passam a secretar maior
quantidade de adipocinas (ácidos graxos não-esterificados, proteína 4 fixadora
do retinol, leptina, FNT-α, resistina e adiponectina) que são responsáveis por
aumentar a resistência à insulina.
·
Ácidos graxos livres prejudicam a utilização
de glicose no músculo esquelético, promovem a produção de glicose pelo fígado e
afetam a função das células β.
·
A produção pelos adipócitos de adiponectina,
um sensibilizador da insulina, é reduzida na obesidade contribuindo para a
resistência à insulina.
·
Os produtos dos adipócitos produzem um estado
inflamatório que podem contribuir para a destruição das células β.,
Maior produção hepática de glicose e
lipídeos: a resistência à insulina reflete a incapacidade de
suprimir a gliconeogênese e de provocar a glicogenese, com isso ocorrerá uma
maior produção hepática de glicose.
A
resistência à insulina e a obesidade aumentam os ácidos graxos livres
aumentando a produção de lipídeos no fígado podendo gerar uma esteatose
hepática não-alcoolica. Uma das consequência é a produção aumentada de
lipoproteínas como o VLDL e de triglicérides o que pode acarretar no
desenvolvimento de dislipidemias tão frequentes no DM tipo 2.
Complicações agudas do DM
·
Cetoacidose
diabética (CAD): os sinais e sintomas do CAD normalmente se
instalam em um período de 24 h, podendo ser um complexo sintomático inicial que
dá origem ao diagnóstico de DM tipo 1, porém ocorre mais frequentemente em
indivíduos com diabetes já estabelecido.
ü Náuseas
e vômitos
ü Dor
abdominal intensa semelhante à da pancreatite aguda ou de ruptura visceral.
ü A
hiperglicemia resulta em glicosuria, depleção volêmica e taquicardia.
ü A
depleção volêmica + vasodilatação periférica = hipotensão.
ü Bafo
cetônico
ü Respiração
de Kussmaul secundária à acidose metabólica.
ü Letargia
e depressão do SNC com possível evolução para coma.
ü Edema
cerebral mais comum em crianças
A
Cetose resulta de um aumento acentuado na liberação de ácidos graxos livres
pelos adipócitos, com um desvio resultante na direção da síntese de corpos
cetônicos no fígado.
·
Estado
hiperosmolar hiperglicêmico (EHH)
O paciente
protótipo com EHH é um indivíduo idoso com DM tipo, com uma história de varias
semanas de poliúria, perda de peso e ingestão oral reduzida que culmina em
confusão mental, letargia ou coma. O EHH é observado principalmente em
indivíduos com diabetes tipo 2.
ü Desidratação
profunda
ü Hiperosmolaridade
ü Hipotensão
A
hiperglicemia induz uma diurese osmótica que acarreta depleção do volume
intravascular, que será exacerbada por uma reposição adequada de líquidos.
Complicações crônicas do DM: O
risco de complicações crônicas aumenta como uma função da duração da
hiperglicemia, como em muitos casos o DM tipo 2 comporta-se assintomaticamente
os indivíduos com essa patologia desenvolvem as complicações na mesma época em
que é feito o diagnóstico.
As
complicações podem ser divididas em: 1)vasculares e 2) não vasculares. As
vasculares ainda são subdivididas em: 1) microvasculares e 2) macrovasculares.
DM como fator de risco cardiovascular
Em
geral pacientes com DM tipo 1 não apresentam dislipidemias se tiverem um bom
controle da glicemia. Os pacientes com o
tipo 2, por sua vez, costumam apresentar dislipidemia, mesmo se tiverem um
controle efetivo da glicemia. Os níveis elevados de insulina , bem como, a
resistência à este hormônio tem múltiplos efeitos sobre o metabolismo dos
lipídios que incluem: 1) diminuição da atividade da LPL, resultando na redução
do catabolismo dos quilomicrons e do VLDL, 2) aumento na liberação de ácidos
graxos livres pelo tecido adiposo, 3) aumento da síntese de ácidos graxos no
fígado e 4) aumento na produção hepática de VLDL. Pacientes com DM tipo 2
normalmente apresentam níveis elevados de VLDL, LDL e níveis reduzidos de HDL.
Critérios diagnósticos de diabetes
melito
Critérios para o diagnóstico de
diabetes melito
|
A1C
≥ 6,5%.
|
GPJ
≥ 126 mg/dL jejum de 8h
|
Teste
de tolerância à glicose (TOTG) após 2h de ingestão de 75g de glicose anidra
dissolvida em água com resultado≥ 200mg/dL
|
Em
pacientes com sintomas e sinais clínicos típicos de hiperglicemia (poliúria,
polidipsia e polifagia) realizar um exame de glicemia aleatório e
diagnosticar DM em caso de glicose ≥ 200mg/dL.
|
GPJ em mg/dL – 8h
|
Classificação
|
< 100mg/dL
|
Normal
|
100 – 125mg/dL
|
Pré-diabetes
|
≥126mg/dL
|
DM
|
Níveis
plasmáticos em mg/dL após 2h do TOTG
|
Classificação
|
140-199mg/dL
|
Pré-diabetes
|
≥200mg/dL
|
DM
|
A1C 5,7 – 6,4% Pré-diabético
|
Pré-diabetes: indivíduos
com TGD (tolerância a glicose diminuída) e/ou GJA (glicose de jejum alterada)
designada recentemente como pré-diabetes correm um risco substancial de virem a
desenvolver DM tipo 2(25 a 40% nos próximos 5 anos) e correm também maior risco de desenvolverem
DCV.
Tratamento não farmacológico do DM
a)
Terapia
nutricional (TNM): pacientes com pré-diabetes ou DM devem
receber de forma individualizada uma terapia médica nutricional, de preferência
acompanhada por um nutricionista, com intuito de alcançarem o sucesso
terapêutico.
o
É recomendada a perda de peso para todos os indivíduos
com sobrepeso ou obesos que são pré-diabéticos ou diabéticos;
o
Dieta
com baixo teor de carboidratos e gorduras, dando preferências às gorduras
monoinsaturadas.
o
Em pacientes com dieta com baixos teores de
carboidrato, monitorar o perfil lipídico, função renal, e proteínas de entrada
ajustando a terapia hipoglicêmica conforme o necessário.
a.1) Terapia nutricional primária: neste
caso o foco é a prevenção do desenvolvimento do DM tipo 2 em pacientes com alto
risco de desenvolver esta doença, o que inclui obesos e pré-diabéticos focando
a redução ponderal de peso.
o
Recomenda-se a perda de peso em 7% da massa
corporal, a pratica de 150 minutos semanais de exercício físico, reduzindo o
consumo de gorduras e de calorias em geral.
o
Estes pacientes devem ser encorajados a
ingerir em média 14g de fibras solúveis para cada 1000Kcal e implementar o
consumo de cereais.
o
Limitar a ingestão de bebidas adoçadas com
açúcar.
a.2) Terapia nutricional secundária: neste
caso a terapia visa a manutenção dos níveis glicêmicos em pacientes que já
desenvolverão o DM.
O
objetivo da TNM no indivíduo com DM tipo 1 consiste em coordenar e equilibrar a
ingestão calórica, em termos temporais e quantitativos, com a quantidade
apropriada de insulina. A TNM no DM tipo 1 e o auto-monitoramento da glicose
sanguínea devem ser integrados de forma a definir o esquema ótimo de insulina.
Os
objetivos no DM tipo 2 são ligeiramente diferentes e enfocam a prevalência
grandemente aumentada de fatores de risco cardiovasculares (hipertensão,
dislipidemia e obesidade). Sendo assim, a perda de peso é enfaticamente
encorajada, bem como, as dietas hipocalóricas.
O
consumo de fibras solúveis pode aprimorar o controle glicêmico nos indivíduos
com DM tipo 2.
Tabela – Metas no tratamento de adultos
com DM
Tipo
|
Níveis plasmáticos
|
A1C
|
<7,0%
|
Glicose plasmática capilar
pré-prandial
|
70 a 130 mg/dL
|
Glicose plasmática capilar
pós-prandial
|
<180mg/dL
|
b) Exercício físico: no
exercício comporta inúmeros benefícios positivos, incluindo redução do risco cardiovascular,
queda da P.A, manutenção da massa muscular, redução da gordura corporal e perda
de peso. Na DM ainda é útil para reduzir a glicemia plasmática (durante e após
o exercício) e aumentar a sensibilidade à insulina.
Para
evitar a hiperglicemia e hipoglicemia relacionadas ao exercício físico, os
indivíduos com DM tipo 1 deveriam:
·
Monitorar a glicose sanguínea antes, durante
e após o exercício;
·
Protelar o exercício se a glicose sanguínea
for > 250mg/dL assim como na presença de cetonas
·
Ingerir carboidratos antes de se exercitar
caso a glicose sanguínea seja < 100mg/dL
·
Monitorar a glicose durante o exercício e
ingerir carboidratos para evitar a hipoglicemia
·
Reduzir as doses de insulina antes do
exercício e injetar insulina em uma área que não está sendo exercitada
·
Ensinar aos indivíduos as respostas da
glicose aos diferentes tipos de exercício e aumentar a ingestão de alimentos
por até 24h pós exercício, dependendo da intensidade e duração deste exercício.
Monitoramento do nível de controle glicêmico
·
Deve ser realizada de 3 a mais vezes ao dia
em pacientes que utilizem múltiplas injeções de insulina ou realizem terapia
com bomba de insulina.
·
Para pacientes com uso menos frequente de
insulina, tratamento não-insulinico ou TNM isolada o monitoramento é útil para
a gestão do quadro glicêmico.
·
O A1C deve ser feito para avaliar o controle
glicêmico a longo prazo, sendo recomendada sua utilização 2 vezes por ano em
indivíduos com DM controlado.







Nenhum comentário:
Postar um comentário
comenta ai vai!!