
Asma
João Lage
Definição:
“Asma é uma doença inflamatória crônica das vias aéreas, de
caráter hereditário, na qual muitas células e elementos celulares têm
participação. A inflamação crônica está associada à hiper-responsividade das
vias aéreas, que leva a episódios recorrentes de sibilos, dispneia, opressão
torácica e tosse, particularmente à noite ou no início da manhã. Esses
episódios são uma consequência da obstrução ao fluxo aéreo intrapulmonar
generalizada e variável, reversível espontaneamente ou com tratamento.”
Epidemiologia: a asma é um problema mundial que afeta tanto adulta como crianças
e atinge cerca de 300 milhões de pessoas. No Brasil estima-se que 20 milhões de
pessoas possuam a doença. Entre 2000 e 2010 ocorreu uma diminuição de 49% nas
hospitalizações pela doença e a taxa aproximada de mortalidade pela doença no
país é de 1,52/100000 habitantes.
Os gastos com a asma grave consome 25% da renda familiar de
classes menos favorecidas, sendo que, a OMS recomenda um gasto inferior a 5%.
Fatores
de risco para asma
|
Episódios de sibilância no primeiro
ano de vida
|
|
Baixa função respiratória
|
|
Infecções virais
|
|
Aumento da IgE sérica total
|
|
Testes cutâneos positivos a
alergenos inaláveis
|
|
Alterações no desenvolvimento do
sistema imunológico
|
|
Tabagismo ativo e passivo
|
|
Exposição a ácaros, poeira, pólen,
mofo, poluentes ambientais, baratas, pelos de animais domésticos.
|
|
Exposição ocupacional
|
|
Uso de determinados medicamentos,
consumo de determinados alimentos e aditivos.
|
|
Predisposição genética com genes relacionados
à atopia (tendência a produzir IgE) e genes relacionados à
hiper-responsividade
|
|
Obesidade (leptina)
|
Fisiopatologia
da asma
Fase sensibilizadora
1. Alérgenos inalados entram em contato
com a mucosa respiratória e são capturados por células dendríticas presentes no
epitélio brônquico, que são capazes de reconhecer, processar o antígeno e
apresentar seus fragmentos peptídicos ligados à molécula de MHC II aos linfócitos
T auxiliares (TH2).
2. Linfócitos TH2 em contato com o
alérgeno produziram citocinas (IL-3, IL-4, IL-5, IL-10, IL-13) que induziram a
replicação de linfócitos TH2.
3. As citocinas produzidas desempenham
importante papel em: 1)estimular LB a produzirem IgE (principalmente IL-4), 2)proliferar
mastócitos e 3)ativação e aumento da sobrevida de eosinófilos.
4. Os mastócitos serão revestidos por IgE.
Fase efetora
1. Quando os mastócitos entram em contato
com o alérgeno ocorrem as seguintes situações: 1)histamina, 2) fatores
quimiotáticos para neutrófilos e eosinófilos (IL-5), 3) prostaglandinas e
leucotrienos, 4) citocinas (IL-3, IL-4, IL-5, IL-6) sendo que a IL-4 contribui
para a produção de IgE pelos LB e 5)GM-CSF.
2. Prostaglandinas e leucotrienos causam
broncoespasmo, aumentam a permeabilidade vascular e potencializam a migração de
células inflamatórias nas vias respiratórias.
3. Neutrófilos potencializam a inflamação
por meio da liberação de enzimas lisossômicas, leucotrieno B4 e
fator de liberação de histamina (HRF).
4. Macrófagos ativam células endoteliais,
recrutam outras células e aumentam a sobrevida dos eosinófilos.
5. Os eosinófilos são recrutados na
circulação em uma fase tardia da inflamação. Tal recrutamento é propiciado por
IL-4 e a maturação e ativação dos eosinófilos fica a cargo de IL-5, IL-3 e
GM-CSF. Os eosinófilos liberam: 1) proteína básica principal (MBP) que irá
lesar o epitélio respiratório, expondo terminações nervosas sensitivas
subepiteliais que respondem a mediadores inflamatórios causadores de
bronquioconstrição, vasodilatação e hipersecreção alem de ativa a liberação de
mediadores por mastócitos, 2) leucotrieno C4 (potente broncoconstritor), 3) fator ativador
de plaquetas (PAF) (constritor da musculatura lisa das vias respiratórias e
aumenta a hiper-reatividade brônquica) alem disso funciona como um quimiotático
de eosinófilos perpetuando um feedback positivo.
6. Células epiteliais brônquicas
participam ativamente do processo inflamatório através da produção de citocinas
e de outros mediadores inflamatórios, como IL-1, IL-6, IL-8, GM-CSF, TGF-β,
endotelina, fibronectina e derivados do ácido araquidônico.
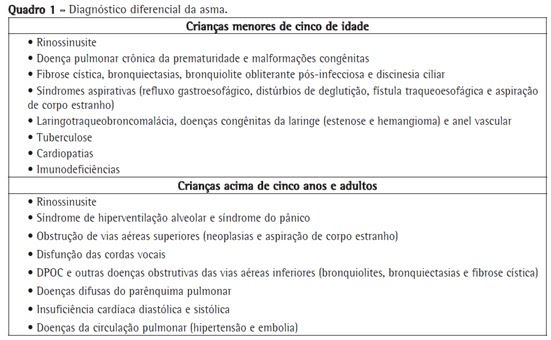
Diagnóstico da asma
1) Clínico:
Anamnese:
o
diagnóstico clínico da asma é sugerido por um ou mais sintomas, como dispneia,
tosse crônica, sibilância, opressão ou desconforto torácico, sobretudo à noite
ou nas primeiras horas da manhã. As manifestações que sugerem fortemente o
diagnóstico de asma são a variabilidade dos sintomas, o desencadeamento de
sintomas por irritantes inespecíficos (como fumaças, odores fortes e exercício)
ou por aeroalérgenos (como ácaros e fungos), a piora dos sintomas à noite e a
melhora espontânea ou após o uso de medicações específicas para asma. Três ou
mais episódios de sibilância no ultimo ano e HF positiva para asma e/ou atopia.
É importante destacar que a asma de início recente em adultos pode estar
relacionada com exposições ocupacionais.
Exame
físico: ao exame físico
algumas alterações podem ocorrer entre elas: 1) sibilos inspiratórios e/ou
expiratórios, 2) hiperinsuflação
pulmonar caracterizando um possível hipertimpanismo à percussão, 3) cianose, 4)
FC > 120bpm e FR > 30 IRPM, 5) fala monossílaba ou incapacidade para
falar, 6) Exaustão, 7) dispneia intensa.
2) Testes
respiratórios
Espirometria: A avaliação funcional da asma, através da espirometria, tem três
utilidades principais: estabelecer o diagnóstico; documentar a gravidade da
obstrução ao fluxo aéreo; e monitorar o curso da doença e as modificações
decorrentes do tratamento.
A confirmação do diagnóstico de asma usualmente é feita através da
espirometria, a qual fornece duas medidas importantes para o diagnóstico de
limitação ao fluxo de ar das vias aéreas: VEF1 e CVF.
O diagnóstico de limitação
ao fluxo aéreo é estabelecido pela redução da relação VEF1/CVF, e a intensidade
dessa limitação é determinada pela redução percentual do VEF1
em
relação ao seu previsto. O diagnóstico de asma é confirmado não apenas pela
detecção da limitação ao fluxo de ar, mas principalmente pela demonstração de
significativa reversibilidade, parcial ou completa, após a inalação de um
broncodilatador de curta ação.
São indicativos de asma:
·
Obstrução
das vias aéreas caracterizada por redução do VEF1 (inferior a 80% do previsto)
e da relação VEF1/CVF (inferior a 75 em adultos e a 86 em crianças).
·
A resposta ao broncodilatador é considerada significativa e indicativa
de asma quando o VEF1 aumenta, pelo menos:
Hiper-responsividade das vias aéreas: a asma pode estar presente em
espirometria normal. Neste caso, na persistência de sintomas clínicos, deve-se
afastar ou confirmar o diagnóstico através do teste de hiper-responsividade. A hiper-responsividade pode ser medida através da inalação
de substâncias broncoconstritoras (metacolina, carbacol e histamina) ou testada
pelo teste de broncoprovocação por exercício. Por sua alta sensibilidade e
elevado valor preditivo negativo, os testes farmacológicos são particularmente
importantes para a decisão diagnóstica, especialmente nos casos com
manifestações de tosse crônica ou dispneia com espirometria normal. Portanto,
um teste de hiper-reatividade negativo afasta a hipótese de asma.
Medidas do estado alérgico:
Existe
uma forte associação entre asma, rinite e outras doenças alérgicas. Estas
informações contribuem muito mais para o planejamento terapêutico do que para o
diagnóstico da asma. A avaliação da atopia requer anamnese cuidadosa e
confirmação da sensibilização alérgica por meio de testes cutâneos ou através
da determinação das concentrações séricas de IgE específica por teste
radioalergoabsorvente. Em nosso meio, os aeroalérgenos mais frequentes são
ácaros, fungos e polens, assim como antígenos de cães, gatos e baratas.
Pico forçado expiratório: possui aproximadamente a
mesma técnica da espirometria sendo mais simples e barato que esta. Os valores
do PFE são listados em uma tabela e variam de acordo com estatura, idade e
sexo.
Aumento de 20% ou mais na
variação diurna do PEF, medido duas vezes por dia, em pelo monos três dias da
semana, durante duas semanas.
Classificações da asma
Tratamento da asma
a) Estabelecimento
de boa relação médico-paciente:
O manejo efetivo da asma necessita do desenvolvimento de uma
parceria entre o paciente asmático e seu médico (e pais/cuidadores, no caso da
criança com asma). O objetivo é permitir que o paciente adquira conhecimento,
confiança e habilidade para assumir o papel principal no manejo de sua doença. A parceria é formada e estreitada quando o
paciente e seu médico discutem e concordam com os objetivos do tratamento,
desenvolvem um plano de ação escrito e personalizado e, periodicamente, revisam
o tratamento e o nível de controle da asma (Quadro 2). Essa abordagem, chamada de
automanejo guiado da asma, reduz a morbidade tanto em adultos quanto em crianças.
b)Eliminar fatores de risco e
desencadeantes
c)Avaliar tratar e manter o controle
da asma:
·
Etapa
1: Na
etapa 1, além de promover a educação do asmático e o controle ambiental,
utiliza-se apenas medicação de alívio para pacientes que têm sintomas
ocasionais (tosse, sibilos ou dispneia ocorrendo duas vezes ou menos por
semana) de curta duração. Entre esses episódios, o paciente está assintomático,
com função pulmonar normal e sem despertar noturno. Para a maioria dos
pacientes nessa etapa, utiliza-se um β2-agonista de rápido início
de ação (salbutamol, fenoterol ou formoterol). As alternativas são
anticolinérgico inalatório, β2-agonista oral ou teofilina
oral, mas esses têm um início de ação mais lento e um maior risco de efeitos
adversos.
·
Etapa
2: Na etapa 2, os corticoides inalatórios em doses baixas são
a primeira escolha.(23,24) Medicações alternativas
incluem antileucotrienos(25-27) para pacientes que não
conseguem utilizar a via inalatória ou para aqueles que têm efeitos adversos
intoleráveis com o uso de corticoide inalatório.
·
Etapa
3: Na etapa 3, a associação de um corticoide inalatório em
doses baixas com um β2-agonista inalatório de
ação prolongada é a primeira escolha. Um β2-agonista de rápido início
de ação é utilizado para o alívio de sintomas conforme necessário.
·
Etapa
4: Na etapa 4, sempre que possível, o tratamento deve ser
conduzido por um médico especialista no tratamento da asma. A escolha preferida
consiste na combinação de corticoide inalatório em doses médias ou altas com um
β2-agonista de ação prolongada. Como alternativa, pode-se adicionar
um antileucotrieno ou teofilina à associação acima descrita.
·
Etapa
5: Na etapa 5, adiciona-se corticoide oral às outras
medicações de controle já referidas, mas deve-se sempre
considerar os efeitos adversos potencialmente graves. Esse esquema somente deve
ser empregado para pacientes com asma não controlada na etapa 4, que tenham
limitação de suas atividades diárias e frequentes exacerbações e que tenham
sido exaustivamente questionados sobre a adesão ao tratamento. Os pacientes
devem ser esclarecidos sobre os potenciais efeitos adversos, e a dose do
corticoide oral deve ser a menor possível para manter o paciente controlado. A
adição de anti-IgE é uma alternativa na etapa 5 para pacientes atópicos, pois
sua utilização pode melhorar o controle da asma e reduzir o risco de
exacerbações.










Nenhum comentário:
Postar um comentário
comenta ai vai!!